2022-2028年中國仿制藥市場深度分析與發展趨勢研究報告
http://www.xibaipo.cc 2021-10-20 11:57 中企顧問網
2022-2028年中國仿制藥市場深度分析與發展趨勢研究報告2021-10
仿制藥是指與商品名藥在劑量、安全性和效力(strength)(不管如何服用)、質量、作用(performance)以及適應癥(intendeduse)上相同的一種仿制品(copy)。世界上將有150種以上總價值達340多億美元的專利藥品保護期到期。到期以后,其他國家和制藥廠即可生產仿制藥。
2016年3月6日,國務院辦公廳日前印發《關于開展仿制藥質量和療效一致性評價的意見》,要求化學藥品新注冊分類實施前批準上市的仿制藥,凡未按照與原研藥品質量和療效一致原則審批的,均須開展一致性評價。
仿制藥是與原研藥具有相同的活性成分、劑型、給藥途徑和治療作用的藥品。進行質量和療效的一致性評價,就是要求對已經批準上市的仿制藥品,在質量和療效上與原研藥能夠一致,在臨床上與原研藥可以相互替代,這樣有利于節約社會的醫藥費用。
仿制的空間:還有巨大的“更具性價比”的可及性未被滿足。
2018H1全球藥品TOP100銷售額
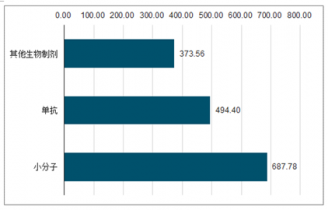
數據來源:公開資料整理
全球藥品TOP100產品類型

數據來源:公開資料整理
中企顧問網發布的《2022-2028年中國仿制藥市場深度分析與發展趨勢研究報告》共十三章。首先介紹了仿制藥行業市場發展環境、仿制藥整體運行態勢等,接著分析了仿制藥行業市場運行的現狀,然后介紹了仿制藥市場競爭格局。隨后,報告對仿制藥做了重點企業經營狀況分析,最后分析了仿制藥行業發展趨勢與投資預測。您若想對仿制藥產業有個系統的了解或者想投資仿制藥行業,本報告是您不可或缺的重要工具。
本研究報告數據主要采用國家統計數據,海關總署,問卷調查數據,商務部采集數據等數據庫。其中宏觀經濟數據主要來自國家統計局,部分行業統計數據主要來自國家統計局及市場調研數據,企業數據主要來自于國統計局規模企業統計數據庫及證券交易所等,價格數據主要來自于各類市場監測數據庫。
報告目錄:
1.1 仿制藥基本介紹
1.1.1 仿制藥基本含義
1.1.2 仿制藥分類情況
1.1.3 仿制藥研發標準
1.1.4 仿制藥研發流程
1.2 仿制藥和原研藥的比較
1.2.1 兩者的聯系
1.2.2 兩者的區別
1.2.3 兩者的療效
第二章 2015-2019年醫藥行業發展分析
2.1 2015-2019年全球醫藥行業發展分析
2.1.1 全球市場發展規模
2.1.2 醫藥研發投入情況
2.1.3 全球藥企銷售狀況
2.1.4 醫藥商業市場現狀
2.1.5 醫藥行業發展趨勢
2.2 2015-2019年中國醫藥行業發展分析
2.2.1 行業發展現狀
2.2.2 市場發展規模
2.2.3 研發投入狀況
2.2.4 醫藥產量分析
2.2.5 醫藥價格情況
2.2.6 醫藥出口貿易
2.2.7 藥企經營情況
2.2.8 藥企盈利能力
2.2.9 醫藥商業發展
2.3 2015-2019年中國醫藥行業投融資分析
2.3.1 醫藥企業并購規模
2.3.2 企業融資輪次情況
2.3.3 細分領域投資狀況
2.3.4 投資并購典型案例
2.4 中國醫藥行業面臨的挑戰
2.4.1 藥品產能過剩閑置
2.4.2 產業自身能力不足
2.4.3 產品品牌知名度低
2.4.4 管理水平高低不等
2.5 中國醫藥行業發展對策建議
2.5.1 調整醫藥產業結構
2.5.2 加大研發投入力度
2.5.3 加強醫藥品牌建設
2.5.4 加大力度支持創新
2.6 中國醫藥行業發展趨勢
2.6.1 單抗藥成為投資熱點
2.6.2 CMO和CSO發展迅速
2.6.3 中醫藥蘊藏發展機會
2.6.4 醫藥產業鏈多元化
2.6.5 醫藥商業集中度提升
2.6.6 一致性評價規范行業
2.6.7 處方藥外流市場效應
第三章 2015-2019年全球仿制藥產業發展狀況分析
3.1 2015-2019年全球仿制藥產業發展分析
3.1.1 仿制藥審批情況
3.1.2 仿制藥市場規模
3.1.3 仿制藥市場格局
3.1.4 原研藥專利到期
3.1.5 仿制藥投資并購
3.1.6 仿制藥處方比例
3.1.7 仿制藥指數走勢
3.1.8 仿制藥企業布局
3.2 2015-2019年美國仿制藥產業發展分析
3.2.1 政策環境
3.2.2 批準情況
3.2.3 市場規模
3.2.4 市場特點
3.2.5 銷售狀況
3.2.6 價格分析
3.2.7 治療領域
3.2.8 投資并購
3.2.9 處方量占比
3.2.10 仿制藥板塊
3.3 2015-2019年印度仿制藥產業發展分析
3.3.1 發展歷程
3.3.1 審評批準
3.3.2 市場規模
3.3.3 藥企營收
3.3.4 研發成果
3.3.5 銷售收入
3.3.6 處方量占比
3.3.7 投融資情況
3.4 2015-2019年日本仿制藥產業發展分析
3.4.1 政策環境分析
3.4.2 市場發展規模
3.4.3 藥品銷售情況
3.4.4 競爭格局分析
3.4.5 研發成本費用
3.4.6 仿制藥占比率
3.4.7 企業發展狀況
3.5 2015-2019年國外仿制藥重點企業發展狀況
3.5.1 Teva
3.5.2 Sandoz
3.5.3 Mylan
3.5.4 Endo
3.5.5 Amneal
3.5.6 Hikma
3.5.7 Lupin
第四章 2015-2019年中國仿制藥產業發展環境分析
4.1 經濟環境
4.1.1 全球經濟形勢
4.1.2 國內宏觀經濟
4.1.3 對外經濟分析
4.1.4 工業運行情況
4.1.5 宏觀經濟趨勢
4.2 政策環境
4.2.1 仿制藥相關政策匯總
4.2.2 優先審評審批制度
4.2.3 醫保目錄談判進展
4.2.4 供應保障及使用政策
4.2.5 “4+7”藥品帶量采購
4.2.6 注射劑仿制藥相關政策
4.3 社會環境
4.3.1 居民收入水平
4.3.2 居民消費水平
4.3.3 居民社會保障
4.3.4 人口構成情況
4.3.5 醫療衛生情況
4.3.6 老齡化問題
第五章 2015-2019年中國仿制藥產業發展分析
5.1 2015-2019年中國仿制藥發展現狀
5.1.1 發展歷程
5.1.2 申報流程
5.1.3 產業鏈
5.1.4 市場規模
5.1.5 競爭格局
5.1.6 審評進展
5.1.7 進口替代
5.1.8 銷售情況
5.1.9 制劑出口
5.2 2015-2019年抗腫瘤仿制藥發展分析
5.2.1 抗腫瘤藥市場發展情況
5.2.2 抗腫瘤仿制藥發展現狀
5.2.3 抗腫瘤仿制藥競爭環境
5.2.4 抗腫瘤仿制藥企業布局
5.2.5 抗腫瘤仿制藥發展戰略
5.3 中國仿制藥重點企業及其產品發展狀況
5.3.1 信立泰
5.3.2 科倫藥業
5.3.3 復星醫藥
5.3.4 翰森制藥
5.3.5 恒瑞醫藥
5.3.6 正大天晴
5.4 第.一批鼓勵仿制藥品目錄
5.4.1 第.一批鼓勵仿制藥建議目錄(一)
5.4.2 第.一批鼓勵仿制藥建議目錄(二)
5.4.3 第.一批鼓勵仿制藥建議目錄(三)
5.4.4 第.一批鼓勵仿制藥建議目錄(四)
5.4.5 第.一批鼓勵仿制藥建議目錄(五)
5.4.6 第.一批鼓勵仿制藥建議目錄(六)
5.5 中國仿制藥產業面臨的主要問題
5.5.1 藥企制劑工藝落后
5.5.2 上下游配套設施差
5.5.3 既往審批標準寬松
5.5.4 產業研發能力弱
5.5.5 同質化競爭嚴重
5.6 中國仿制藥產業發展建議分析
5.6.1 鼓勵藥企增大研發投入
5.6.2 加快藥品專利鏈接制度
5.6.3 堅持仿制藥一致性評價
5.6.4 避免藥品短缺及同質化
第六章 仿制藥一致性評價發展狀況分析
6.1 仿制藥一致性評價相關概述
6.1.1 基本定義
6.1.2 發展歷程
6.2 2015-2019年仿制藥一致性評價進展
6.2.1 一致性評價進展(按時間)
6.2.2 一致性評價進展(按企業)
6.2.3 一致性評價進展(按產品)
6.2.4 一致性評價進展(按地區)
6.2.5 注射劑一致性評價進展
6.3 2015-2019年我國BE試驗進展
國產仿制藥與進口原研產品同臺競爭,在保證質量的前提下,快速實現進口替代。化學仿制藥進展:底子薄、工程大,將貫穿長期。據調查數據顯示,到2020年,仿制藥占處方藥的比例會進一步上升至92%。
2018年BE試驗開展

數據來源:公開資料整理
6.3.1 豁免BE/BE試驗
6.3.2 BE試驗申請情況
6.3.3 BE試驗登記情況
6.3.4 BE試驗市場主體
6.4 一致性評價招標采購實踐
6.4.1 陜西省
6.4.2 上海市
6.4.3 福建省
6.4.4 浙江省
6.4.5 廣西省
6.5 開展仿制藥一致性評價的意義
6.5.1 患者受益
6.5.2 過評企業受益
6.5.3 審批部門受益
第七章 2015-2019年中國生物仿制藥(生物類似藥)產業發展分析
7.1 生物仿制藥相關概述
7.1.1 生物仿制藥的定義
7.1.2 生物仿制藥和化學仿制藥的區別
7.1.3 生物仿制藥和生物原研藥的區別
7.2 2015-2019年生物仿制藥發展現狀分析
7.2.1 發展歷程
7.2.2 發展環境
7.2.3 發展現狀
7.2.4 市場份額
7.2.5 市場規模
7.2.6 研發投入
7.2.7 技術門檻
7.3 生物仿制藥熱門靶點分析
7.3.1 HER2
7.3.2 CD20
7.3.3 VEGF
7.3.4 EGFR
7.3.5 TNFα
7.3.6 其他靶點
7.4 生物仿制藥主要產品分析
7.4.1 阿達木單抗
7.4.2 曲妥珠單抗
7.4.3 貝伐珠單抗
7.4.4 利妥昔單抗
7.4.5 英夫利昔單抗
7.5 典型生物仿制藥藥企——Celltrion
7.5.1 發展現狀
7.5.2 研發成本
7.5.3 專利到期
7.5.4 投融資分析
7.6 生物仿制藥存在的問題
7.6.1 研發成本高
7.6.2 投資收益低
7.6.3 接受程度低
第八章 中國化學仿制藥發展分析
8.1 化學仿制藥相關介紹
8.1.1 基本含義
8.1.2 化學藥品分類
8.1.3 藥品等效分級
8.2 化學仿制藥相關政策分析
8.2.1 生物等效性試驗備案管理規定
8.2.2 化學藥品注冊分類改革工作方案
8.2.3 化學仿制藥一致性評價技術要求
8.2.4 化學仿制藥相關申報資料要求
8.2.5 仿制藥參比制劑遴選與確定程序
8.2.6 注射劑仿制藥一致性評價要求
8.3 2015-2019年化學仿制藥(注射劑)發展狀況分析
8.3.1 發展現狀
8.3.2 市場規模
8.3.3 申報情況
8.3.4 市場格局
8.3.5 典型案例
8.3.6 注射劑國際化
8.4 國內化學仿制藥(注射劑)重點企業——普利制藥
8.4.1 發展歷程
8.4.2 獲批情況
8.4.3 競爭優勢
8.4.4 注射用阿奇霉素
8.4.5 注射用更昔洛韋鈉
8.4.6 注射用伏立康唑
8.4.7 注射用泮托拉唑
8.4.8 其他注射劑產品
8.5 化學仿制藥一致性評價存在的問題
8.5.1 投入資金大且周期長
8.5.2 參比試劑選擇難度大
8.5.3 一致性評價門檻極高
8.5.4 臨床試驗法律不健全
第九章 2015-2019年國外重點仿制藥上市企業分析
9.1 梯瓦制藥(Teva)
9.1.1 企業發展概況
9.1.2 2017年企業經營狀況分析
9.1.3 2018年企業經營狀況分析
9.1.4 2019年企業經營狀況分析
9.2 邁蘭公司(Mylan)
9.2.1 企業發展概況
9.2.2 2017年企業經營狀況分析
9.2.3 2018年企業經營狀況分析
9.2.4 2019年企業經營狀況分析
9.3 Hikma制藥
9.3.1 企業發展概況
9.3.2 2017年企業經營狀況分析
9.3.3 2018年企業經營狀況分析
9.3.4 2019年企業經營狀況分析
9.4 西普拉制藥(Cipla)
9.4.1 企業發展概況
9.4.2 2017年企業經營狀況分析
9.4.3 2018年企業經營狀況分析
9.4.4 2019年企業經營狀況分析
9.5 賽爾群(Celltrion)
9.5.1 企業發展概況
9.5.2 2017年企業經營狀況分析
9.5.3 2018年企業經營狀況分析
9.5.4 2019年企業經營狀況分析
9.6 太陽制藥(SunPharma)
9.6.1 企業發展概況
9.6.2 2017年企業經營狀況分析
9.6.3 2018年企業經營狀況分析
9.6.4 2019年企業經營狀況分析
9.7 魯賓制藥(Lupin)
9.7.1 企業發展概況
9.7.2 2017年企業經營狀況分析
9.7.3 2018年企業經營狀況分析
9.7.4 2019年企業經營狀況分析
第十章 國內重點仿制藥上市企業分析
10.1 恒瑞醫藥
10.1.1 企業發展概況
10.1.2 經營效益分析
10.1.3 業務經營分析
10.1.4 財務狀況分析
10.1.5 核心競爭力分析
10.1.6 公司發展戰略
10.2 復星醫藥
10.2.1 企業發展概況
10.2.2 經營效益分析
10.2.3 業務經營分析
10.2.4 財務狀況分析
10.2.5 核心競爭力分析
10.2.6 公司發展戰略
10.3 京新藥業
10.3.1 企業發展概況
10.3.2 經營效益分析
10.3.3 業務經營分析
10.3.4 財務狀況分析
10.3.5 核心競爭力分析
10.3.6 公司發展戰略
10.4 科倫藥業
10.4.1 企業發展概況
10.4.2 經營效益分析
10.4.3 業務經營分析
10.4.4 財務狀況分析
10.4.5 核心競爭力分析
10.4.6 公司發展戰略
10.5 普利制藥
10.5.1 企業發展概況
10.5.2 經營效益分析
10.5.3 業務經營分析
10.5.4 財務狀況分析
10.5.5 核心競爭力分析
10.5.6 公司發展戰略
10.6 華東醫藥
10.6.1 企業發展概況
10.6.2 經營效益分析
10.6.3 業務經營分析
10.6.4 財務狀況分析
10.6.5 核心競爭力分析
10.6.6 公司發展戰略
10.7 華海藥業
10.7.1 企業發展概況
10.7.2 經營效益分析
10.7.3 業務經營分析
10.7.4 財務狀況分析
10.7.5 核心競爭力分析
10.7.6 公司發展戰略
第十一章 中國仿制藥項目投資建設案例分析——江蘇吳中
11.1 西洛他唑等上市化學仿制藥的一致性評價
11.1.1 項目投資背景
11.1.2 項目基本情況
11.1.3 項目投資計劃
11.1.4 項目投資價值
11.1.5 項目經濟效益
11.1.6 項目風險與對策
11.2 利奈唑胺與沃諾拉贊的仿制
11.2.1 項目投資背景
11.2.2 項目基本情況
11.2.3 項目投資計劃
11.2.4 項目投資價值
11.2.5 項目經濟效益
11.2.6 項目風險與對策
第十二章 2022-2028年仿制藥產業投資分析及價值評估
12.1 全球仿制藥企業投融資狀況分析
12.1.1 Mylan
12.1.2 Teva
12.1.3 Cipla
12.1.4 Lupin
12.2 中國仿制藥企業投融資狀況分析
12.2.1 京新藥業
12.2.2 華海藥業
12.2.3 復星醫藥
12.2.4 石藥集團
12.3 中國仿制藥投資壁壘
12.3.1 先行者壁壘
12.3.2 競爭壁壘
12.3.3 價格壁壘
12.3.4 技術壁壘
12.3.5 原料壁壘
12.3.6 審評壁壘
第十三章 2022-2028年仿制藥產業投資前景及趨勢預測
13.1 仿制藥產業發展趨勢分析()
13.1.1 發展方向
13.1.2 發展戰略
13.1.3 發展趨勢
13.2 2022-2028年仿制藥產業預測分析
13.2.1 影響因素分析
13.2.2 市場規模預測
圖表目錄
圖表 不同類型的仿制藥的研究周期、回報率及挑戰
圖表 生物藥注冊分類與創新藥界定
圖表 典型仿制藥(化學制劑)研發流程
圖表 仿制藥和原研藥的療效對比
圖表 2015-2019年全球醫藥市場規模及同比增長走勢
圖表 2015-2019年全球生物藥市場規模
圖表 2015-2019年FDA批準新藥數量
圖表 2019年全球制藥公司研發預算排行榜
圖表 2019年全球藥企銷售TOP15(中國區)
圖表 2022-2028年全球醫藥市場規模統計及預測
圖表 2019年醫藥行業企業數量及虧損情況
圖表 2019年醫藥行業企業數量及虧損情況
圖表 2015-2019年中國醫藥市場規模及增長
圖表 2015年與2019年A股藥企研發投入對比
圖表 2019年中國主要醫藥產量及增速
圖表 2015-2019年醫藥類商品零售價格指數情況
圖表 2019年醫藥行業出口交貨值情況
圖表 2019年份醫藥產業分子行業主營業務收入
圖表 2019年醫藥行業主營業務收入
圖表 2019年醫藥行業主營業務收入
圖表 2019年醫藥產業分子行業利潤總額
圖表 2019年醫藥行業盈利能力趨勢圖
圖表 2015-2019年中國醫藥行業并購市場交易金額及增長
圖表 2015-2019年中國醫藥行業并購市場交易金額分布
圖表 2015-2019年中國醫藥行業并購市場交易數量及增長
圖表 2015-2019年中國醫藥行業并購市場交易數量分布
更多圖表見正文......








